Axcelead では、これまでの創薬研究で培った技術や知識を活かし、新規開発候補化合物の創出、あるいは核酸創薬研究の課題に対するソリューションをご提供致します。
創薬ステージや課題に応じて、各種試験を統合的に実施できます。
1. 核酸の配列最適化
標的mRNAに対するアンチセンスオリゴ核酸 (ASO) の配列を、効率的に最適化します。
- 毒性リスク低減のため、オフターゲット解析によりmRNA上の探索領域を絞り込み
- 安全性・毒性懸念のある特徴的配列の回避
- 二次構造を考慮し、凝集や自己会合性の起こりにくいデザイン
- 活性と安全性のバランスの優れた、修飾核酸・修飾パターンの最適化

2. 核酸の動態・分布評価
標的組織の細胞までの送達評価 (PK/PD解析)
薬効が不十分な場合、標的組織の細胞(核)までの送達が十分ではないことが原因の一つとして考えられます。Axceleadでは、定量分析と可視化技術を組み合わせて、届けたい場所に届いているかを細胞レベルで解析します。
- 定量分析
多数の実績 (組織、細胞)に基づき、LC-MS/MSやHybridization ELISAから最適な方法を選択、迅速に結果をご返却します。 そのほかリガンド核酸の分析や代謝物の解析もお任せください。
組織での測定実績:日本核酸医薬学会第8年会 ポスターP2-41 Fig 2,3,5
細胞での測定実績:日本核酸医薬学会第8年会 ポスターP2-80 Fig 8-11
- 可視化技術
抗PS抗体を用いたIHCによるASOとtarget mRNAに対するin situ hybridizationの共染色により、細胞レベルで送達と活性を解析します(日本核酸医薬学会第8年会 ポスターP2-80 Fig 5, 6)。
投与したASOをISHで染色し、可視化した実績については日本核酸医薬学会第8年会 ポスターP2-41 Fig 4をご覧ください。
核酸の可視化技術についてはこちらでも紹介しております。
3. 核酸の送達技術
ペプチド-核酸コンジュゲートのデザイン・合成
ペプチドは核酸医薬が直面するデリバリーの課題を解決する一つの手段です。標的組織・細胞への送達の課題を解決するために、適切なペプチド-核酸コンジュゲートのデザイン・合成を行います。
弊社で培われたペプチド創薬の “インフラ・技術・ノウハウ” を最大限に活用し、お客様の目的に合わせたペプチド-核酸コンジュゲートをご提案します。
実施内容)
・膜透過性ペプチド、標的受容体リガンドペプチドの合成
・ペプチドの特性に合わせた最適なリンカーの提案
・コンジュゲートの合成・精製


4. 核酸の薬効評価
- 各種Cell lineや分化済みiPS細胞を用いた様々なヒト細胞 (病態モデル)を準備して、多様な表現型解析が可能です
- 臨床外挿性の高い病態モデル動物において医薬品候補の薬効評価を行い、臨床試験に向けたデータを提供します
- ゲノム編集技術(CRISPR/Cas9システム)を用いて、目的遺伝子の欠失や変異の挿入を持つ遺伝子改変マウス・ラットを効率的に作出し提供します
核酸の薬効評価について詳細はこちら
5.核酸の安全性評価
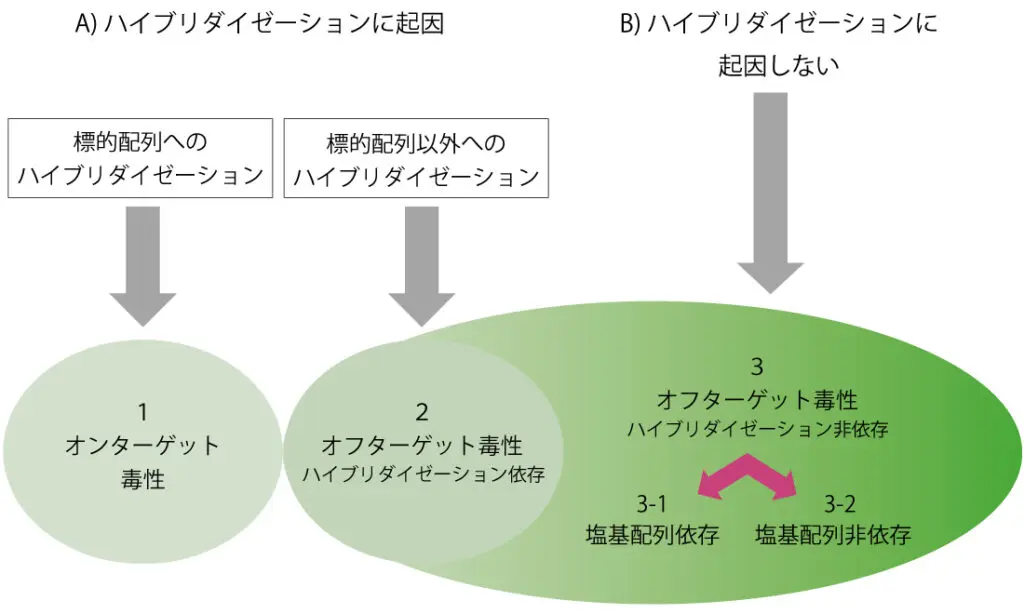
核酸医薬品で認められる毒性には、A)ハイブリダイゼーションに起因した毒性、B)ハイブリダイゼーションに起因しない毒性があります。A)のうち、2-1)オフターゲット毒性 (ハイブリダイゼーション依存)は核酸医薬品に特有であり、ヒトでの毒性リスクの低い核酸医薬品候補の選択が重要です。B)は、従来型の毒性試験において概ね検出が可能といわれていますが、核酸医薬品でしばしば問題となる免疫系毒性、血液系毒性、肝臓・腎臓の毒性に注意すべきです。
1.Target Safety Assessmentによるオンターゲット毒性調査
2.In silico解析およびin vitro試験によるオフターゲット毒性(ハイブリダイゼーション依存)の軽減
3.多様な毒性評価系による、オフターゲット毒性(ハイブリダイゼーション非依存)の評価(免疫系、肝臓、腎臓の毒性へのケア)